EL ÁTOMO
Cada uno de los objetos que puedes ver a tu alrededor ocupa un espacio y puede medirse.
Estos objetos reciben el nombre de materia, por lo tanto, podemos decir que la materia es
todo aquello que ocupa un lugar en el espacio y tiene masa.
En el siglo V a. C., Demócrito postuló que la materia estaba formada por partículas muy
pequeñas e indivisibles: los átomos. Estos no se pueden dividir, por tanto el átomo es la unidad constituyente más pequeña de la materia que posee las propiedades de un elemento
químico.
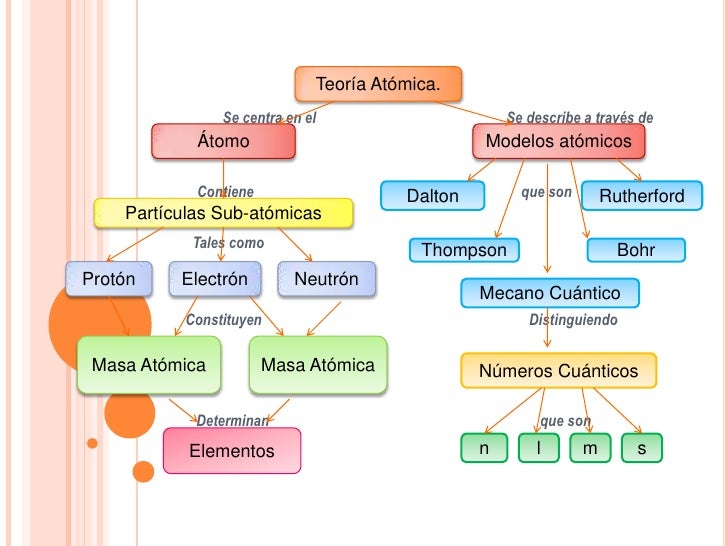
Tabla periódica
Permite establecer relaciones entre los diferentes elementos, sus propiedades y su comportamiento químico. En 1869, el ruso Dimitri Mendeleiev y, en 1870, el alemán Lothar Meyer, de manera independiente, presentaron su tabla periódica con 63 elementos. La tabla periódica de ese tiempo presentaba estas características:
• Los elementos aparecían ordenados en filas horizontales en las que su masa atómica aumentaba de izquierda a derecha.
• Los elementos de una misma columna vertical tenían propiedades semejantes. Sin embargo, para agruparlos fue necesario invertir el orden de masas atómicas de algunos elementos; cambiar el valor entonces conocido de la masa atómica de ciertos elementos; dejar huecos para elementos cuyas características se predecían, pero que aún no habían sido descubiertos.
Ley periódica
• En cada grupo aparecen los elementos que presentan el mismo número de electrones en el último nivel ocupado, o capa de valencia.
La tabla periódica actual consiste en un cuadro de doble entrada en el que los elementos están agrupados en siete períodos (filas) y dieciocho grupos (columnas). Veamos la siguiente característica:
• En cada período aparecen los elementos para los que el último nivel de su configuración electrónica coincide con el número del periodo, situados por orden creciente del número atómico
La disposición de los elementos en el sistema periódico actual no se produce al azar, sino que responde a la llamada ley periódica, que se enuncia así: “Muchas propiedades físicas y químicas de los elementos varían con regularidad periódica cuando estos se sitúan por orden creciente de su número atómico”.
Propiedades periódicas
Son propiedades que presentan los átomos de un elemento y que varían en la Tabla Periódica siguiendo la periodicidad de los grupos y periodos de ésta. Por la posición de un elemento podemos predecir qué valores tendrán dichas propiedades así como a través de ellas, el comportamiento químico del elemento en cuestión. Tal y como hemos dicho, vamos a encontrar una periodicidad de esas propiedades en la tabla. Esto supone por ejemplo, que la variación de una de ellas en los grupos o periodos va a responder a una regla general. El conocer estas reglas de variación nos va a permitir conocer el comportamiento, desde un punto de vista químico, de un elemento, ya que dicho comportamiento, depende en gran manera de sus propiedades periódicas.
Hay un gran número de propiedades periódicas. Entre las más importantes destacaríamos:
- Estructura electrónica
- Radio atómico
- Volumen atómico
- Potencial de ionización
- Afinidad electrónica
- Electronegatividad:
- Carácter metálico
- Valencia iónica
- Valencia covalente
- Radio iónico
Para reforzar toda la temática de átomo y tabla periódica vista en clase, puede observar el siguiente vídeo o ingresar al siguiente texto en línea: https://educacion.gob.ec/wp-content/uploads/downloads/2016/09/librostexto/Texto_quimica_1_BGU.pdf



Este comentario ha sido eliminado por un administrador del blog.
ResponderEliminarEste comentario ha sido eliminado por un administrador del blog.
Eliminar