EL CARBONO
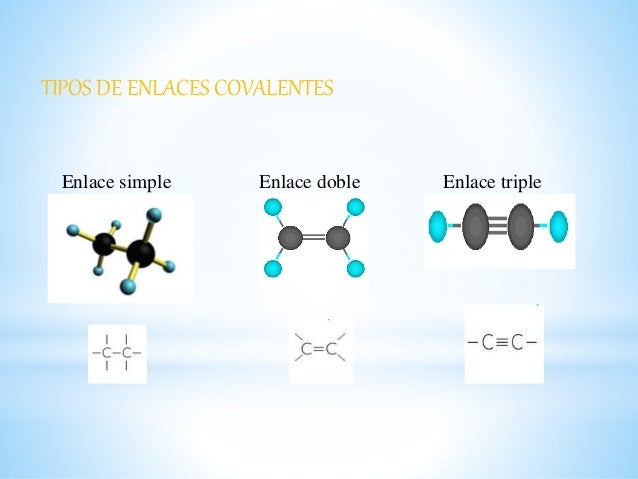
El carbono puede unirse a otro carbono o a otros elementos mediante enlaces covalentes simples, dobles o triples, según compartan uno, dos o tres pares de electrones, respectivamente. Con el resto de los enlaces, los átomos de carbono se unen, como ya hemos dicho, a otros átomos. Cada átomo de carbono puede unirse a tantos elementos como enlaces libres posea. Las cadenas carbonadas pueden ser abiertas o cerradas; las abiertas pueden ser ramificadas y las cerradas o ciclos también pueden tener sustituyentes.
Para reforzar toda la temática del carbono vista en clase, puede observar los siguientes vídeos o ingresar al siguiente texto en línea: https://educacion.gob.ec/wp-content/uploads/downloads/2016/09/librostexto/Texto_quimica_3_BGU.pdf
Bibliografia:
https://educacion.gob.ec/wp-content/uploads/downloads/2016/09/librostexto/Texto_quimica_1_BGU.pdf
COMPUESTOS AROMÁTICOS
Aunque no se conocen totalmente cómo fueron las reacciones que dieron lugar a las primitivas formas de vida, ciertos
factores intervinieron en aquellas reacciones: el agua, la luz
solar y el carbono. Este último es un elemento no metálico
con una presencia variada en nuestro planeta.
La química orgánica estudia los compuestos del carbono. Inicialmente se creyó que los compuestos químicos que intervienen en los procesos vitales poseían una especie de impulso
vital que los caracterizaba y que solo se podían obtener a
partir de seres vivos. No obstante, en 1828 el científico alemán
F. Wöhler (1800-1882) sintetizó por primera vez una sustancia
orgánica, la urea, a partir de sustancias definidas como no
orgánicas. A partir de esta reacción se desechó la teoría de
que ciertas sustancias poseían un principio vital.
La estructura atómica del carbono le otorga gran capacidad para formar enlaces covalentes muy estables. Por esta razón, el carbono es el elemento que presenta mayor número de
compuestos.
El carbono tiene número atómico Z = 6 y su isótopo más abundante tiene número másico
A = 12. Por tanto, su núcleo está formado por 6 protones y 6 neutrones. Alrededor del núcleo
se mueven 6 electrones.
Estos cuatro enlaces covalentes se pueden establecer entre el carbono y otros elementos
(como H, N, O, P, S, etc.), o bien entre átomos de carbono.

El carbono puede unirse a otro carbono o a otros elementos mediante enlaces covalentes simples, dobles o triples, según compartan uno, dos o tres pares de electrones, respectivamente. Con el resto de los enlaces, los átomos de carbono se unen, como ya hemos dicho, a otros átomos. Cada átomo de carbono puede unirse a tantos elementos como enlaces libres posea. Las cadenas carbonadas pueden ser abiertas o cerradas; las abiertas pueden ser ramificadas y las cerradas o ciclos también pueden tener sustituyentes.
Para reforzar toda la temática del carbono vista en clase, puede observar los siguientes vídeos o ingresar al siguiente texto en línea: https://educacion.gob.ec/wp-content/uploads/downloads/2016/09/librostexto/Texto_quimica_3_BGU.pdf
Bibliografia:
https://educacion.gob.ec/wp-content/uploads/downloads/2016/09/librostexto/Texto_quimica_1_BGU.pdf
COMPUESTOS AROMÁTICOS
Tomado de: https://blogger.googleusercontent.com/img/b/R29vZ2xl/AVvXsEgOXznsmUX7xKU6NXwT_GCpXwzlqvfSAVo_c8tYZgo1byKnthIge5WuTKIEvnwgfMIHD2deaVaPfGkX46Zsc0qTBmLBZz2hl_J2n35xYgZEvTvh30tBrVN2px4R8sC86ATLuX9IJPVV-EA3/s1600/info+plataforma.png



Muchas gracias profe por la. Herramientas
ResponderEliminar